בימים שבהם נכתבות השורות הללו, מרחפת אי ודאות כבדה מעל חייהם של חוליו של ד"ר לו יו, אונקולוג מבית החולים של אוניברסיטת סצ'ואן בצ'נגדו שבסין. מבחינתם, זהו שיפור גדול במצב; לולא החלטתו של לו יו להכליל אותם בניסוי פורץ דרך בבני אדם שיערך החודש באמצעות טכנולוגיה חדשנית לעריכת גנים, הם היו חיים בוודאות מלאה, אבל ללא שמץ של תקווה: לאיש מהם לא היה סיכוי לשרוד.
כל החולים שנבחרו להשתתף בניסוי סובלים מסוג מסוים מאוד של סרטן ריאות. גופם אינו מגיב להקרנות, לכימותרפיה או לטיפולים אחרים, והמשמעות היא שלרופאים אין כל דרך למתן את התפשטות הגידולים או להציל את חייהם.
במהלך החודש הקרוב ינסה ד"ר לו יו לעשות את הבלתי אפשרי ולהעניק לחוליו סיכוי מחודש לחיות. אפילו ההסבר הפשטני של מה שהוא הולך לעשות - אותה עריכת גנים - מסובך להבנה: לו יו ואנשיו יוציאו מדמם של החולים תאים חיסוניים שנקראים תאי T ויטפלו בהם באמצעות טכנולוגיה חדשנית ששמה קריספר-קאס9, טכנולוגיה שמחברת בין מעין מדריך מולקולרי המסוגל לזהות רצף של גנים ספציפיים על כרומוזום, לאנזים שמסוגל "לחתוך" את הגנים האלה החוצה.
במקרה של החולים של לו יו, מטרת ה"חיתוך" תהיה גן שאחראי לייצור חלבון בשם PD-1, המונע מהגוף הפעלת תגובה חיסונית. תאי הסרטן מצליחים "להתחפש" לתאים בריאים ובכך - ותוך הפעלת החלבון הזה - נמנעת המערכת החיסונית מלתקוף אותם. אצל החולים של לו יו הגן הזה ייחתך מתאי ה-T, התאים שטופלו יעברו תהליך של ריבוי מהיר במעבדה, ואז יוזרקו לתוך דמם של החולים. לפי התכנון, התאים המהונדסים יתפשטו במערכת הדם שלהם והחוקרים מקווים שתוך זמן קצר יתמקדו בתאים הסרטניים ויחסלו אותם. הניסוי שייערך על החולים לא ישפיע על התורשה שלהם, ולכן - למרות החששות הרבים שיש סביב רפואת גנים - לא נשמעו התנגדויות קולניות לעריכתו.
ולמה שבעצם יהיו בכלל התנגדויות, אתם שואלים? בעיקר משום שאם טכנולוגיית קריספר-קאס9 אכן תוכיח את עצמה - ולא מעט סימנים מראים שכך יהיה - הנתיב המהיר לעריכה גנטית של תכונות בבני אדם יהיה פתוח לרווחה. לא רק שמדענים יוכלו להתערב בתאי גזע עובריים ולחסל מראש מחלות גנטיות, אלא שהם גם יוכלו להשפיע על אלמנטים אחרים במבנה הגנטי של התינוקות שייוולדו. רוצים תינוק עם עיניים כחולות? אין בעיה; רוצים תינוקת אינטליגנטית מהרגיל ובעלת גפיים ארוכות? רק תבקשו; רוצים ליצור דור שלם של תינוקות חזקים, מהירים ובעלי נטייה מולדת לצייתנות? אם רק תצליחו לגלות מהם הגנים הספציפיים האחראיים לכל תכונה ולהתגבר על מכשולים אתיים שמן הסתם יערמו, הטכנולוגיה החדשה תאפשר לכם ליצור את האדם המושלם.
אבל זו לא הסיבה היחידה לכך שלצד ההתרגשות האמיתית שמעוררת טכנולוגיית הקריספר-קאס9, היא מעוררת גם פחדים עמוקים בקרב לא מעט מדענים ואנשי רוח. אף שהיא מתוארת כשיטה מדויקת מאין כמוה לעריכה של די-אן-איי, לא מעט רופאים חוששים שטיפול בגן מסוים עשוי ליצור בעיות אחרות. נטרול גן הגורם להשמנת יתר, למשל, עשוי לגרום לאדם שמתאיו הוצא הגן גם לפתח מערכת חיסונית מוחלשת; השתלה של גן המזוהה עם אינטליגנציה גבוהה במיוחד, עשויה אולי להתבטא גם בבני אדם שבריאותם הנפשית תהיה רופפת. וכן הלאה.
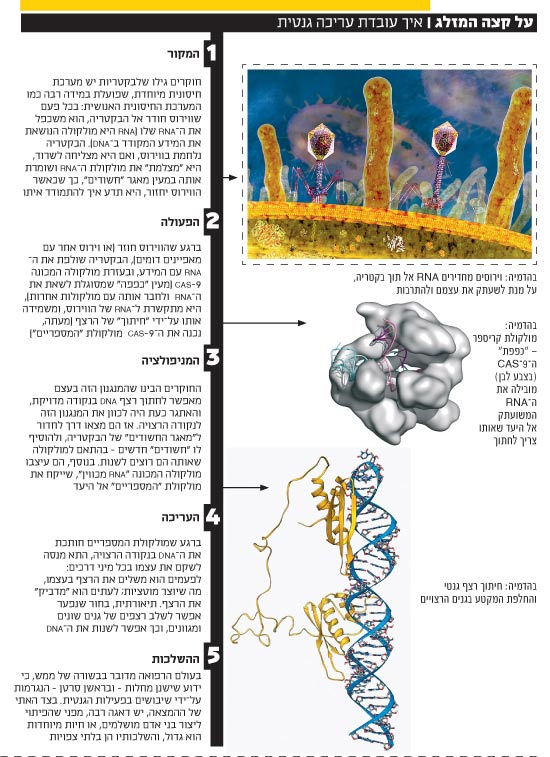
איך זה עובד?
המחקר בקריספר נולד לפני כמעט שלושים שנים כאשר מדענים מיפן שחקרו גנים של חיידק מעיים מסוים, מצאו שרצף הדי-אן-איי שלו מכיל כמה מקטעים זהים, וביניהם רווחים שאותם הם כינו "ספייסרים". בשנת 2000 זיהו חוקרים רצפים דומים וביניהם ספייסרים גם במינים אחרים של בקטריות. ב-2002 שונה השם שניתן למקטעים הללו ל-CRISPR (ראשי תיבות של Clustered Regularly Interspaced Short Palindromic Repeats) לאור הגילוי כי הרצפים תמיד מופיעים ליד גנים המאפשרים לייצר אנזימים שיכולים לחתוך את הדי-אן-איי. "מכשירי החיתוך" הללו קיבלו את השם cas.
מנקודה זאת, החל המחקר בנושא להתקדם במהירות מסחררת. לפני 11 שנים גילו כמה קבוצות מחקר כי הספייסרים לא היו מרווחים ריקים אלא הכילו די-אן-איי זר ומכך הסיקו שהספייסרים הם למעשה חלק ממערכת החיסון של בקטריות: ברגע שווירוס חודר לבקטריה, מערכת הקריספר חותכת מקטעים מהדי-אן-איי של הפולש ושומרת אותו על רצף הספייסרים כדי לעשות בו שימוש עתידי לצורכי הגנה.
ב-2007 נעשה לראשונה שימוש מסחרי בידע הזה: חברת דאניסקו השתמשה בספייסרים כדי להקנות לחיידקים עמידות נגד וירוסים מסוימים, וזאת במטרה למנוע זיהומים בייצור יוגורט. ב-2010 גילו מדענים אחרים כי ישנם כמה סוגים של קריספר שחלקם תוקפים מולקולות אר-אן-איי בעוד שאחרים מתמקדים במולקולות די-אן-איי.
פריצת הדרך המשמעותית ביותר בתחום נעשתה לפני ארבע שנים. על-ידי מי בדיוק? זו שאלה שהתשובה עליה תוכרע בבתי משפט בעוד שנים, ושהשלכותיה בתמלוגים יגיעו למיליארדי דולרים, אבל בינתיים קורעת את הקהילה המדעית בארצות הברית לשני מחנות, שאותם ניתן לשרטט בגסות לפי שיוך גיאוגרפי. מחנה אחד עומד לצדן של הגנטיקאיות ג'ניפר דואדנה האמריקאית ועמנואל שרפנייה השבדית מאוניברסיטת קליפורניה שבברקלי, ומחנה אחר תומך במהנדס הביו-רפואי פנג ז'אנג מהמכון הטכנולוגי של מסצ'וסטס.
אין מחלוקת על כך שב-2012 הדגימו שתי החוקרות מקליפורניה את השימוש במערכת הקריספר-קאס לחיתוך די-אן-איי מחוץ לחיידק. החידוש במחקר של השתיים היה שימוש ברצף אר-אן-איי מסוים ובחלבון cas יחיד שכולל בתוכו את כל האזורים הנחוצים לקשירה ולפתיחה של די-אן-איי וחיתוכו ולא בקומפלקס של חלבונים שונים. אנזים ה-cas נמצא בחיידק הסטרפטוקוקוס המוכר למדי, והוא כונה cas9. גילוי שני האלמנטים הללו הפך את השימוש במנגנון לפשוט וליעיל והפך אותו מיד לכלי המועדף בהנדסה גנטית.
"פריצת הדרך היא בגילוי מנגנון הגנה על 'מערכת החיסון' של החיידק", מסביר ד"ר נועם שומרון שעומד בראש מעבדת מחקר בתחום הגנומיקה בבית הספר לרפואה של אוניברסיטת תל אביב. "בחיידק קיימת מערכת שאפשר לדמות אותה ל'מכונת צילום' ול'מספריים'. החיידק 'מצלם' קטעים מהדי-אן-איי של הווירוס שתוקף אותו, ושומר את הצילום ב'ספרייה' או במטען הגנטי הפנימי שלו. בעתיד, כאשר אותו חיידק שוב יתקל בווירוס הוא ישתמש ב'צילום' כדי להיזכר באותו פולש וישתמש ב'מספריים' כדי לחתוך או לנטרל את התוקף. המערכת הזו נועדה להגן על החיידק ולאפשר את שרידותו. מכוון שהמידע שנחשף אליו החיידק נשמר בדי-אן-איי, הוא עובר גם אל הדורות הבאים של החיידקים, כלומר כאשר חיידק מתחלק, המידע עובר לתאי הבת. בפועל, כשהנכד של הנכד של החיידק הזה יפגוש שוב את הווירוס, הוא ישלוף את הצילום, יזהה את הפולש, ויפעיל את המספריים במטרה לחתוך ולחסל אותו. זו מערכת הגנה מופלאה שתורגמה גם לפעילות בתאי אדם".
ד"ר שומרון מתאר גם כיצד הפכו החוקרים את הגילויים הללו למשהו יישומי. "לקחו את המערכת מהחיידקים ויישמו אותה על גנום של עכבר שסובל ממחלה בעקבות מוטציה בגן מסוים" הוא מתאר. "המערכת שהועברה לתאי העכבר יודעת לזהות 'צילום' של הגן המתוקן שהוחדר לתאים במקביל, בנוסף ליכולות החיתוך, כלומר המספריים, המסופקים לתאים. מה שמיוחד בשיטה הזו, לעומת שיטות אחרות של ריפוי גנטי שקימות כבר עשרות שנים, זה שזה עובד טוב, ביעילות גבוהה ובאופן מדויק. זו מערכת פשוטה יחסית ונוחה לשימוש וכתוצאה מכך המעבר לניסויים בבני אדם מהיר".
במקביל לניסויים של שתי החוקרות מקליפורניה, עסק פנג במחקר דומה מאוד בחופה המזרחי של ארצות הברית, והגיע לגילויים זהים. אלא שנחישותו של פנג לזכות בבכורה על הגילוי הייתה כנראה חזקה יותר. בעוד שדואדנה ושרפנייה מהחוף המערבי הגישו את הבקשות שלהן לפטנט לפני שפנג הגיש את הבקשה שלו, הפטנט הוענק לו ראשון משום שהוא סימן את הרובריקה "לטפל בדחיפות" ושילם סכום נוסף כלשהו עבור השירות. במילים אחרות: הזכות לפטנט שאולי ישנה את כל מה שאנו יכולים לדמיין על הגנטיקה של חיידקים, צמחים, בעלי חיים ובני אדם, ועל מדע הרפואה, נפלה לידי המדען שהוסיף עוד כמה גרושים עבור משלוח בדואר שליחים במקום בדואר רגיל.
השאלה האתית
גם אם נשים בצד את הסכסוך המשפטי והמדעי, מעוררת טכנולוגיית הקריספר-קאס9 שאלות הרות גורל רבות אחרות. "מה שמעניין הוא שהטכנולוגיה הזו יישומית לא רק בחיידקים, בחיות ובבני אדם אלא למערכות אקולוגיות שלמות", אומר ד"ר שומרון. "תחשוב לרגע מה ההשלכות על הסביבה אם אפשר יהיה לשנות באמצעות שיטה זו אוכלוסייה שלמה. לדוגמה, ליצור יתושים שאינם יכולים לשאת את נגיף המלריה. במקרה של ניסויים בבני אדם ההשלכות הן רק על אותו מטופל. לעומת זאת, ההשלכות של שינוי אוכלוסייה של חרקים יכולה להשפיע על הסביבה כולה ואף יכולה לשנות בצורה קיצונית את התמותה של בני אדם, ממלריה למשל. בתרגם מידי, יתכן ואחוזי התמותה ממלריה ירדו פלאים מה שיגדיל במליוני אנשים את האוכלוסייה באפריקה, תוך מספר שנים בלבד. במקרה כזה, הסופר-יתוש שיווצר ישנה את פני הדמוגרפיה והכלכלה של יבשת שלמה.
"במהלך השנים, היה חשש שיתפרץ איזשהו 'יצור על' מאחת המעבדות שישתלט על העולם, יתחרה עם האוכלוסייה הטבעית ובסופו של דבר יחסל אותה. בשנות השמונים אפילו הקימו בארה"ב ועדות שיפקחו על ניסויים המערבים ריפוי או שינוי גנטי. לפני כשלוש שנים הרשויות בארה"ב החליטו להקל על ניסויים בריפוי גנטי מכוון שהגיעו למסקנה שהסכנות לא גדולות כפי שחשבו תחילה. זה היה נכון עד גילוי המנגנון של קריספר. עכשיו נראה שאנו שוב עומדים בפני מצב חדש לגמרי".
ד"ר שומרון מציע לצנן מעט את ההתלהבות מהאפשרות להכחדת הסרטן בקרוב באמצעות טיפול בטכנולוגיית קריספר מהסיבה הפשוטה שסרטן היא מחלה שנגרמת על ידי מוטציות במספר רב יחסית של גנים. עם זאת, הוא אופטימי לגבי טיפול במחלות שפוגעות בגנים ספציפיים ובמקומות ידועים בדי-אן-איי, למשל סיסטיק פיברוזיס. לגבי הניסויים בסין, אומר ד"ר שומרון כי "אם נוסו על החולים כל השיטות המקובלות מבלי שיהיו להן תוצאות חיוביות, ותהליך המחלה הולך ומדרדר, כלומר נשקפת סכנה חמורה לחיי המטופל, חשוב להשתמש בטכנולוגיות חדשות כולל קריספר". אגב, איש אינו יודע עדיין מה הסיכויים של חולי הסרטן הסינים להחלים, אולם במקרה שהתאים המהונדסים ישכפלו את עצמם, ההשפעה תחול תוך זמן קצר מאוד - ימים בודדים.
ד"ר יוסי בוגנים, ביולוג מולקולרי שעומד בראש מעבדה למחקר בתאי גזע עובריים באוניברסיטה העברית, אומר כי השינוי שיבצעו המדענים יהיה לצמיתות אך ורק בתאי ה-T המהונדסים. "הם יכניסו את הקריספר והוא יחתוך את הדי-אן-איי של תאי ה-T ואז ייצא מהתאים. תראה, יש עוד פתרונות שעובדים על תאי ה-T. למשל, תרופה כמו קיטרודה, שבנויה מנוגדן שחוסם את החלבון PD-1 שנמצא על תאי ה-T. אם תא סרטני תופס את החלבון, הוא בעצם אומר לתא ה-T 'אל תפעיל את מערכת החיסון כנגדי'. התרופה חוסמת את החלבון הזה, ואז התא הסרטני מזוהה ומחוסל על-ידי המערכת החיסונית. אבל לתרופה הזו יש יעילות מוגבלת, ולכן הסינים אומרים משהו אחר: 'בואו פשוט נהרוס את החלבון הזה שנקרא PD-1, ואז תאי הסרטן לא יוכלו לעכב את תאי ה-T. זה מה שהם רוצים לעשות בניסויים עם החולים בסרטן הריאה - לקחת מהחולה את תאי ה-T שלו, תאי מערכת החיסון, להרוס את החלבון הנקרא PD-1 כדי שתאי הסרטן לא יוכלו להסתתר, ולהחזיר את התאים המהונדסים לגוף. על פניו, במצב כזה כל מערכת החיסון תתחיל לעבוד בשלב הזה נגד הגידול.
"אי אפשר לדעת כמה זמן זה ייקח, וכל חולה יגיב בצורה אחרת, אבל חשוב להבין שחלבון ה-PD-1 הוא רק מנגנון אחד שדרכו תאי הסרטן אומרים לגוף 'אל תהרגו אותי', ושיש הרבה מנגנונים נוספים. הסינים מתרכזים במנגנון אחד, ויכול להיות שזה לא יעבוד כי תאי הסרטן עשויים להשתמש במנגנון אחר כדי לעכב את פעילות תאי ה-T. אבל אני מאמין שבהרבה מקרים זה יעבוד בצורה יעילה, ואם זה יעבוד, ניתן יהיה לחשוב אפילו על ריפוי מלא. עם זאת, יכול להיות שזה יוריד את הגידול ב-99.99% ובכל זאת משהו יישאר. זה הקושי בלהילחם בסרטן. הגנום שלו לא יציב, וזה מביא לייצור של המון מוטציות, שאחת מהן יכולה להקנות לתאים הסרטניים עמידות גם לטיפול כזה".
בעתיד, אומר בוגנים, ינסו חוקרים אף להחדיר לתאים מהגוף מקטעי די-אן-איי חדשים ולבנות משהו אחר. "ישנה אפשרות לתקן די-אן-איי פגום. הדוגמה הראשונה שעולה לי לראש היא מחלות שבהן יש מוטציה בגן מסוים בתאי גזע שיוצרים את הדם ומערכת החיסון, שגורמת לתאים האלה לפעול בצורה לא תקינה או אפילו לפתח גידולים סרטניים. אם אפשר לתקן את המוטציה הזאת, בעצם נתקן את מערכת החיסון של אותם אנשים, אבל זה יקרה בשלב הבא".
האם אנו יכולים להיות בטוחים שטיפול בגן אחד לא יביא לתוצאות לא צפויות? שומרון לא משוכנע. "בדיוק מהסיבה הזו חוקרים בארה"ב החליטו שלא לעבור בשלב זה לניסויים בבני אדם. לאחר דיונים רבים הם הגיעו למסקנה שהטכנולוגיה אמנם מבטיחה אך גם צעירה מאוד. בדרך כלל טכנולוגיה מבשילה בתוך תקופה של עשור או יותר שנים. במקרה כאן, תוך שנתיים הייתה קפיצת מדרגה אדירה, שהובילה לניסויים בתאי אדם ובעכברים. האמריקאים רוצים להאט את הקצב במעט, לפחות כשמדובר בבני אדם, מכוון שלא מיצו את כל הניסויים בחיות ועדיין אי אפשר לדעת מה תהיינה כלל ההשלכות בניסויים הללו. הסינים לעומת זאת כבר החלו ניסויים גם בעוברי אדם (בניגוד לאמריקאים. ש' ס'). חשוב להדגיש - הם אמנם הוכיחו שהמערכת עובדת בבני אדם, אך מי שקורא היטב את המאמר שם לב שהחוקרים האמריקאים כנראה צדקו בהחלטתם, ועושה רושם שהשינויים המיוחלים משנים את הדי-אן-איי גם בתאים שאינם מיועדים לטיפול.
"הטכנולוגיה הפתיעה אותנו בכך שהיא עובדת בצורה נהדרת. במעבדת מחקר בתחום הקליני השאיפה היא תמיד לחפש הקשר מידי לטיפול בבני אדם. תחום המחקר של הקריספר כל כך התקדם בזמן האחרון ששמים לב לתופעה מעניינת שבה חוקרים מבקשים לא לעבור לניסויים בבני אדם בשלב מוקדם זה. זו כנראה הפעם הראשונה שאני מכיר שבה מדענים מאטים את קצב הניסויים ועוצרים לשקול היטב את השלבים הבאים במחקרם. בעיני זה תקדים מבורך מכוון המוביל את המדענים לא רק להתרכז במדע אלא גם בהשלכות האתיות של המחקר".
כשד"ר שומרון נדרש לסכנות הקונקרטיות של היכולת לערוך גנים באמצעות המנגנון החדשני, הוא לא מודאג במיוחד מעצם הניסויים בבני אדם כל עוד הם תחת בקרה מתמדת. "המטרה היא תמיד להקל על סבלם של בני אדם. אף אחד לא רוצה לטעות ולגרום לנזק בלתי הפיך. אבל שכשמסתכלים על הרמה האקולוגית ההשפעה, ההשלכות והסכנות גדולות בהרבה. בהתאם לכך, לאחרונה התחילו בארה"ב ניסויים תחת בקרה מחמירה כדי לעקוב אחר אוכלוסיית חרקים שקיבלו 'תכונות-על' ולהבין את גודל המהפכה שהביאה עמה שיטת הקריספר. נוצר דו-שיח בריא בין ביו-אתיקאים וחוקרים במעבדה, לכן אני חושב שזו תקופה נהדרת בעולם המחקר שבו הדיון הוא חלק חשוב ובלתי נפרד מהריצה קדימה אל עבר טיפול מתקדם בבני אדם".
ד"ר בוגנים מזכיר את ההשפעות הלא ספציפיות העלולות לצוץ כתוצאה משימוש בטכנולוגיה. "למרות שהקריספר מכוון לאזור מאוד מסוים, הוא עלול לחתוך גם במקום אחר. הוא לא חותך בצורה חד ערכית אלא קרוב מאוד לכך. תתאר לך מצב שבעצם חתכת גן שהוא אנטי סרטני והפרעת לפעילות שלו. או ביטלת גן שיצר את הסרטן ריאה, אבל יצרת סיכוי ללימפומה. עם זאת, מכיוון שאנחנו מדברים על תאי T ולא על תאים שעוברים אל הדור הבא כמו ביציות או תאי זרע, הבעיה האתית קטנה יותר מכיוון שההשפעות לטוב או לרע מוגבלות לפרט שהטיפול ניתן לו. בעיניי, הניסוי שייערך עכשיו בסין הוא ניסוי לגיטימי למרות שתיאורטית, ואי אפשר לדעת את זה מראש, הוא יכול לגרום אף למוות של החולים כתוצאה מהפעלה חזקה מדי של המערכת החיסונית שעלולה לתקוף גם תאים בריאים".
עם זאת, ד"ר בוגנים מתייחס לאקטים של התערבות חיצונית בקריספר לתיקון של מוטציות כאל פוטנציאל לבעיה מהותית הרבה יותר. "נניח תתקן מוטציה בעובר, אבל תחתוך במקום אחר. זה אומר שכל הגוף של העובר יכלול את החיתוך הזה, וזה כולל גם את תאי המין שלו כי אתה עושה את זה בשלב מאוד מוקדם. זה מסוכן מאוד כי זה יכול לעבור בתורשה. אתה יכול למשל לתקן מוטציה קטלנית בעובר אבל במקביל - ואם הקריספר יחתוך בנקודה אחרת - לגרום ולו ולצאצאיו מחלות אחרות".
כלומר, שחררנו לקהילה פצצת זמן גנטית?
"לא יודע אם לקהילה, אבל לפחות עבור האדם הזה והילדים שלו תהיה סכנה מסוימת. כמובן שאם הדברים הללו יתגלו בגיל מאוחר יותר, הסיכוי שהתכונות הללו יעברו הלאה והלאה באוכלוסיה גדל. זו הסכנה הגדולה, ועל זה דנות עשרות ועדות אתיות. נושא אחר הוא כמובן אנשים שירצו ילד בלונדיני או ילד שיגדל להיות בגובה מטר תשעים. יש פחד מכך שייצרו במעבדה איזה סוג של סופרמן, או אדם לפי בקשה, וזה כמובן יוצר בעיה אתית גדולה הרבה יותר".
על קצה המזלג / איך עובדת עריכה גנטית