כאשר פרופ' עמנואל שרפנטייה, שנחשבת אחת האמהות של טכנולוגיית קריספר (CRISPR) לעריכה גנטית, לצד פרופ' ג'ניפר דודנא וחוקרים נוספים, הודיעה ב-2013 שבכוונתה לחזור לחקור מחלות זיהומיות, הורמו גבות רבות. אחרי הכול, מדובר באחת הטכנולוגיות פורצות הדרך של העשור האחרון ורבים רואים בה מועמדת לפרס נובל.
"העמיתים שלי הופתעו מכך שאני פחות מעוניינת לעסוק ביום-יום שלי ביישום הכלי הזה למחקר גנטי ולהנדסה גנטית", היא מספרת בראיון ל"גלובס", "אבל אמרתי להם, הרי הגעתי מתחום המחלות הזיהומיות. כך גיליתי את הקריספר, שהוא בעצם מנגנון הגנה של חיידקים מפני וירוסים. גם אחרי הגילוי, אני אותה אישה, אותה חוקרת, רק שעכשיו אני חוקרת משופרת. לולא חקרתי מחלות זיהומיות, לא הייתי מגלה את הקריספר. כמובן, לולא הייתי מגלה את הקריספר, כנראה לא היו נותנים לי להקים מכון לחקר מחלות זיהומיות בקבוצת מכוני מקס פלאנק, אבל ברגע שהם החליטו להאמין בי, הם נותנים לי לעשות מה שאני מבינה".
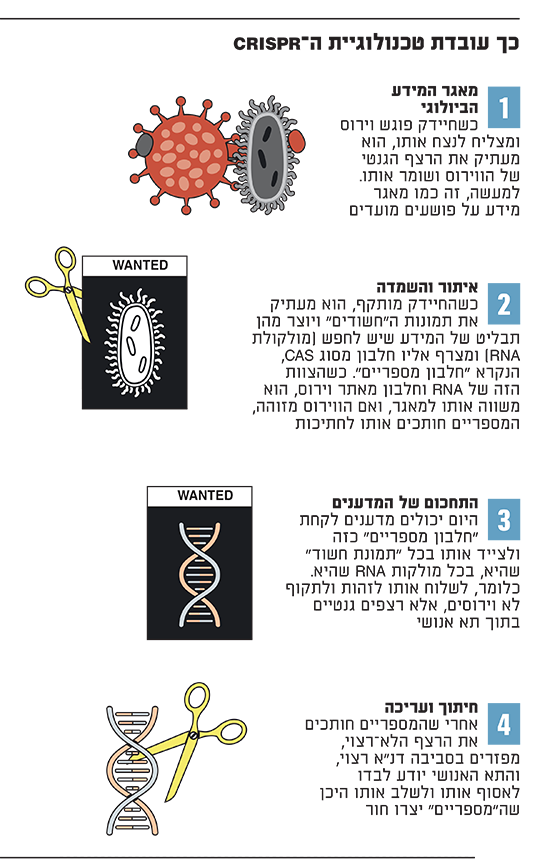
כך עובדת טכנולוגיית ה-CRISPR
"מעט מדינות נערכו כמו שצריך"
כמו חוקרים אחרים בתחום המחלות הזיהומיות, פרופ' שרפנטייה מתוסכלת מהיחס שקיבל חקר הווירולוגיה לאורך השנים. "בחרתי בתחום המחלות הזיהומיות משום שהבנתי מהר מאוד את העול שהן יוצרות", היא מספרת. "כשהחלה מגפת ה-HIV, הגורמת למחלת האיידס, הבנו שווירוסים מתפתחים במהירות ונעים בעולם במהירות, והם עדיין גורם המוות המוביל בראייה גלובלית. אז מה אם בשנים האחרונות הן היו פחות נפוצות במדינות הנחמדות שלנו? שכחנו שהווירוסים הם חסרי גבולות.
"העולם נכשל לגמרי במוכנות לאיום הזה, שכולנו ידענו שהוא קיים. איך הגענו למצב הזה שבו אנשים דופקים בדלת של בית החולים ולא יכולים לקבל טיפול, שיש סבירות גבוהה שיציל אותם? זה היה חלק מהתחזית, אך מעט מאוד מדינות נערכו לכך כמו שצריך. האם באמת היה כל כך קשה לדעת מראש שצריך להכין מלאי גדול של מסכות רפואיות?".
שרפנטייה מעידה, כפי שהעידה גם פרופ' ברכה רגר בראיון שקיימנו עמה לאחרונה, על מיעוט התקציבים למחקר. "כחוקרת מחלות זיהומיות הייתי סוג ב', הגראנטים שלי היו סוג ב' ופרסמתי בכתבי עת סוג ב', ואני ממליצה לכולם, תקראו את כתבי העת סוג ב', כי משם לפעמים יגיעו הרעיונות בעלי ההשפעה המדהימה ביותר.
"אני לא קיבלתי מענק כדי לגלות את הקריספר. הסטתי חלק מהמענקים שקיבלתי בתחומים אחרים כדי לחקור חיידק שלא עניין אף אחד, למרות הקטלניות שלו. כרגע הוא רגיש לפניצילין ואנשים לא חושבים צעד קדימה, על היום שבו הוא יהיה לא רגיש.
"כמו שמגוון ביולוגי אובד עם שינוי האקלים, כך אופנות עלולות לגרום לאובדן של מגוון חוקרים, ואז כשמגיעה מגפה אנחנו מחפשים את האדם עם הידע הספציפי הרלוונטי, ומגלים שאין. צריך ללכת יחד יותר לשטח - אפידמיולוג עם רופא עם אנתרופולוג עם חוקר אבולוציה. היום התחרותיות בין התחומים ובתוך התחומים רבה מדי, אנשים נשפטים על הפרסום הבא ולא על הניסיון להבין תחום אחד לעומק".
תקווה לבדיקה ביתית זולה
היום שרפנטייה משלבת בין התחומים ומשתמשת בטכנולוגיית הקריספר למאבק בווירוס הקורונה. היא לא היחידה שחושבת שללהיט המדובר בתחום ההנדסה הגנטית של תאים אנושיים עשוי להיות תפקיד משמעותי במגפה הנוכחית. גם דודנא, הפועלת כעת באוניברסיטת ברקלי, מגייסת את הטכנולוגיה הזאת למלחמה בקורונה.
"היום אנחנו, יחד עם בית חולים בברלין, משתמשים בטכנולוגיית הקריספר לעריכה גנטית של תאים אנושיים כדי לזהות את הגורמים בתא האנושי שהם חשובים להישרדות של הווירוס, כדי להבין את מנגנוני ההתקשרות. כך אנחנו מוצאים מטרות חדשות לתרופות ולחיסונים", אומרת שרפנטייה.
מחקר כזה יכול לעזור לענות על שאלה נוספת - האם יש הבדלים גנטיים בין מי שרגיש לווירוס לבין מי שעמיד בפניו. אם יש הבדלים, ייתכן שאפשר לבודד אוכלוסיות באופן סלקטיבי.
דודנא משתמשת בטכנולוגיית קריספר כדי לפתח בדיקה ביתית. "זה פיתוח שכבר התחלנו לעבוד עליו לזיהוי של מחלות אחרות", היא אומרת בשיחה עם "גלובס". "עכשיו האצנו אותו מאוד והכוונה היא להגיע לתוצאה בתוך כמה שבועות, במקום כמה שנים טובות. כדי לעשות זאת, היינו צריכים לתאם בין כמה צוותים של כמה מעבדות, בברקלי ובסטנפורד ובמכון המחקר גלדסטון, המתמחה במחלות ללא מרפא, ובחברות ביוטק מקומיות. כמובן, הצוות גובש באופן וירטואלי, מה שמקשה עוד יותר על העבודה.
"אנחנו משתמשים בטכנולוגיה של הקריספר ושולחים אותה לזהות רצפים ייחודיים לווירוס, ולגזור אותם באופן הגורם לכך שיתחבר במקום סמן שאפשר לזהות ממש בקלות, בלי הציוד הדרוש לבדיקות PCR (שיטה ליצירת העתקים של דגימת דנ"א במהירות). זה משהו הרבה יותר מהיר והרבה יותר נייד, והמטרה היא שאנשים ישתמשו במטוש כדי לדגום את עצמם ויקבלו תוצאה במקום.
"אנחנו כבר יודעים היום לעשות זאת במעבדה, כלומר הטכנולוגיה הבסיסית ‘פתורה' ואף כתבנו עליה מאמרים. השאלה היא אם נוכל להפוך את הבדיקה המעבדתית לבדיקה ביתית. האם אפשר להאיץ פיתוח כזה בסדרי גודל על ידי שיתוף פעולה רוחבי והרבה מאוד כסף? יש לנו תוכנית פעולה, שעל בסיסה אני אומרת בזהירות שזה יכול להיות".
התרחיש האופטימי הוא שכל אחד יבדוק בעצמו אם נדבק בווירוס לפני היציאה מהבית בכל יום, ולא ייצא אם הוא חולה. אבל זה תלוי גם במחיר הבדיקה.
דודנא: "אנחנו עוד לא יודעים מה יהיה המחיר בדיוק, אבל אנחנו מדברים על כ-20 דולר לבדיקה. זול מ-PCR, אבל עדיין קצת יקר לבדיקה יומיומית, אז ננסה שזה יהיה יותר זול. בטוח שזה עדיין זול יותר מלהשבית עובדים כי חוששים מהדבקה המונית או כי הם כבר חולים. אולי החברות יממנו את זה לעובדיהן".
לדברי דודנא, הקבוצה שלה אינה היחידה שעובדת בכיוון הזה. "גם חברת ביוטק בשם שרלוק מבוסטון, וגם באוניברסיטת MIT בוחנים כיוונים דומים".
אם קריספר נועד לאפשר לחיידקים להגן על עצמם מפני וירוסים, אולי הוא יכול גם להיות תרופה נגד הווירוס?
דודנא: "הרעיון הזה בהחלט עלה ויש קבוצת חוקרים באוניברסיטת סטנפורד, בראשות פרופ' סטנלי קי, שעוסקת בכך".
קי וצוותו הצליחו להראות שכאשר הם מסנתזים רכיב של הווירוס בתוך תמיסה, מספרי הקריספר הייחודיות שפיתחו, השונות מעט מה-CRISPR-Cas9, מצליחות לחתוך ולנטרל 90% מהחומר הוויראלי. אולם עד כה לא הוכח הדבר בווירוס האמיתי - לא בתאים שהודבקו בו ובטח לא בבני אדם.
"קי אמר לנו שהוא הגיע לשלב שבו הוא צריך לבדוק את התרופה שלו בדגימות של תאים שנלקחו מחולים במחלה, אבל המעבדה שלו אינה מורשית לעבוד עם הווירוס הפעיל, ולכן אנחנו מנסים להשיג לו גישה למעבדה כזו כאן אצלנו", אומרת דודנא.
"אתגר נוסף של הטכנולוגיה הזאת הוא להביא את הקריספר לתאי הריאות. אני מעורבת בפעילות של קבוצת חוקרים שניסתה לפתח את שיטת ההולכה לריאות כדי לטפל בחולים במחלה הגנטית סיסטיק פיברוזיס, וכעת הקבוצה הזו מנסה לעשות שינוי כיוון מהיר כדי לראות אם תוכל להוליך תרופת קריספר לריאות כדי להילחם בקורונה".
הדור הבא של האנטיביוטיקה?
לטכנולוגיית הקריספר יש יישום נוסף אפשרי לקורונה. בעקבות מחקרים כמו אלה של שרפנטייה, המשתמשים בקריספר כדי לגלות גנים רלוונטיים במיוחד למנגנון ההדבקה, אפשר יהיה בהמשך להשתמש בטכנולוגיה הזאת גם כדי לשנות את הפעילות הגנטית בתאים הללו. "אפשר להעלות ולהוריד את הביטוי בתאים של גנים שהופכים את התא לרגיש למחלה כמנגנון הגנה או בתאים שכבר נדבקו, והשאלה היא שוב - איך מביאים את התרופה לתוך כל התאים. אני חושבת שאם נצליח לפתח את הכלי הזה, הוא יהיה בעל ערך גם במגפות עתידיות", אומרת דודנא.
מה הדבר הבא מבחינת הקריספר, בלי קשר לקורונה?
שרפנטייה: "ישנה מחשבה שהקריספר יכול להפוך בעצמו לאנטיביוטיקה מאוד מדויקת, שתפגע רק בחיידק מסוים ולא אחר".
דודנא: "אנחנו מוצאים וירוסים שכנראה גם להם יש מספרי קריספר מסוגים שונים, שנועדו להגן על וירוס אחד מפני וירוס אחר. אלה כלים עוד יותר קטנים מ-CRISPR-Cas9 ולכן עשויים להתאים יותר להולכת חומרים לתוך תאים. אנחנו מאוד מחכים לחזור למחקר הזה. בינתיים הכול מושבת".
לשרפנטייה יש חזון אופטימי-פסימי לגבי מלחמת האדם בווירוסים. "במחלות הוויראליות הטבע מראה כמה הוא חזק, כמה הוא מהיר בתגובות שלו. אלה מחלות שאפשר לבנות אסטרטגיה כדי להילחם בהן, אבל הן תמיד ינצחו. אם יש לך חיסון, הווירוס ימצא בסוף את הדרך לעקוף אותו. זו כמובן לא סיבה לא לפתח חיסונים, אבל אין סיבה לחשוב שמחלות ויראליות ייעלמו מתישהו. תזכרו, שחפת הורגת 1.5 מיליון איש בשנה. האם שמעתם על כך לפני המגפה? לא שמעתם כי זה קורה כרגע לא ליד הבית, אלא למישהו אחר".
בכל זאת, יש גם סיבה לאופטימיות. "החלום הוא להבין את האבולוציה של הווירוסים, ואז אולי נוכל להיות מוכנים עם אפשרות תגובה עוד לפני שהווירוס עצמו מבין את המהלך הבא שלו. יש מעבדות שמנסות היום להכניס וירוסים של בעלי חיים, שנראה כי יש סכנה שיעברו לבני אדם, לכל מיני מצבים של סטרס כדי לראות איזו אבולוציה הם יכולים לעבור. זו עבודה מסוכנת מאוד כי היא יוצרת וירוסים חדשים, אבל היא גם מעניינת כי היא יכולה להוביל להיערכות מראש עם בדיקות סקר, אולי אפילו חיסונים, או לכל הפחות עם אזהרות לגבי הסיכון הגלום בקרבה מסוימת לזן מסוים של בעלי חיים שיכול להיות מסוכן".
פרס וולף שקיבלתן השנה נחשב מנבא של פרסי נובל. אתן חושבות שתקבלו אותו?
שרפנטייה: "כל הזמן שואלים אותי על כך. אני מעריכה שיום יבוא והטכנולוגיה הזאת תקבל פרס נובל, והוועדה של הפרס תצטרך לבחור מי מהחוקרים יקבלו. עם זאת, אני חייבת לציין שיש עוד המון טכנולוגיות מדהימות שלא קיבלו הכרה".
דודנא: "מבחינתי, פרס וולף כבר מייצג את ההכרה של הקהילה המדעית בתחום שלנו, ואנחנו כמקבלות הפרס מייצגות את ההכרה בכל החוקרים שעבדו בתחום. הלוואי שאוכל באמת להגיע לישראל לקבל אותו".
המהפכה שהקפיצה את המחקר הגנטי
מנגנון העריכה הגנטית קריספר (בשמו המלא CRISPR-Cas9) נולד לאחר ששרפנטייה ודודנא גילו שחיידקים מגינים על עצמם מפני וירוסים באמצעות חלבון שיודע לחתוך חומר גנטי במקום מאוד מדויק. בגילוי היו מעורבים חוקרים נוספים, אך הן נחשבות לאימהות הטכנולוגיה. הן גילו שניתן להחליף רכיב ב"מספריים" האלה כדי לכוון אותן לחתוך דנ"א לפי בחירתנו. הן גם גילו שאשר חותכים את הדנ"א, לפעמים הוא מתקן את עצמו באופן טבעי לכיוון הרצוי, או שאפשר לעודד אותו לעשות את זה.
"חקרתי עמידות של חיידקים לאנטיביוטיקה, המבוססת על העמידות שהם פיתחו לאויביהם הטבעיים", מספרת שרפנטייה על הגילוי מנקודת מבטה. "התמקדתי בחיידק בשם Streptococcus pyogenes , שהורג כחצי מיליון איש בעולם בשנה וגורם תחלואה בקרב מאות מיליונים, בין היתר באמצעות מנגנון של 'חיידק טורף'. "זיהינו את החומר הגנטי בבקטריה שלא היה ידוע לפני כן. למעשה, פוסט-דוקטורנטית שלי היא ששמה את האצבע לראשונה על המולקולה הזאת שהפכה למפורסמת, והצגנו אותה בכנס בעין גדי. שם העולם שמע עליה לראשונה, אך אז עוד התייחסנו אליה בעיקר בגלל תפקידה בחיידקים. ככל שהעמקנו לחקור, הבנו שהיא יכולה להיות כלי לעריכה גנטית פשוטה. אפילו לפני שהראינו זאת במעבדה, הבנתי את המנגנון והייתי די בטוחה שזה יעבוד.
"היופי של המנגנון הזה הוא שהוא מורכב מאוד אבל פשוט ויעיל מאוד לתפעול. הוא מתאפשר משום שהחיידק הוא זה שבנה את המכונה הזאת לאורך שנים של אבולוציה. ומה שאני מאוד אוהבת בסיפור הזה הוא שחקר החיידק, שנועד כדי להתגונן מפניו, הביא אותנו לשימוש ביכולות שלו כדי להתגונן מפני בעיות אחרות.
"כמו שחיידק הסטרפטוקוקוס פיתח את הקריספר המסוים שכל העולם משתמש בו היום, לכל החיידקים יש כלי התגוננות שונים נגד אויביהם, ואנחנו רק מתחילים ללמוד איך להשתמש בהם וליישם אותם לצרכים שלנו".
הקריספר הפך תחילה לכלי מחקרי רב עוצמה ופשוט מאוד לשימוש בהשוואה לכלי עריכה גנטית קודמים, שהשתמשו בווירוס כדי להחדיר חומר גנטי לתא. בעקבות הגילוי וההוזלה המשמעותית של כלים לריצוף גנטי, קפץ המחקר הגנטי מדרגה. כיום כל סטודנט לתואר מתקדם יכול להנדס לעצמו תאים במעבדה.
עד היום הטכנולוגיה יועדה בעיקר למחקר ולטיפול במחלות גנטיות תורשתיות והיא משמשת בטיפולים אימונותרפיים בסוגים מסוימים של סרטן. התחומים האלה מתקדמים והולכים, וכמה חברות כבר החלו בניסויים קליניים.
שרפנטייה ודודנא עצמן היו שותפות להקמה של חברות בתחום העריכה הגנטית, ובין המוסדות המעסיקים אותן ובין החברות שהקימו היו גם מאבקי פטנט מרים.
בינתיים, החברות מתקדמות לעבר טיפולים בבני אדם. חברת CRISPR Therapeutics ששרפנטייה הייתה שותפה בהקמתה ונסחרת בנאסד"ק ב-2.8 מיליארד דולר, מבצעת ניסויים קליניים בתחום האימונו-אונקולוגיה.
דודנא הייתה שותפה להקמת החברות Caribou Biosciences, Editas Medical, Intellia Therapeutics, Mammoth Biosciences ו-Scribe Therapeutics. עד כה, הניסויים מלמדים שהטכנולוגיה, המשמשת לעריכת תאים מחוץ לגוף והחזרתם, בטוחה לשימוש ויש סימנים מעודדים ליעילות.
הכתבה פורסמה במקור באפריל 2020 ועלתה לכותרות מחדש בעקבות זכייתן של השתיים בפרס נובל לכימיה