חשוב להתחיל מהסוף: לא, הממשלה לא ניצלה את משבר הקורונה כדי לאפשר ליצרני חיסונים לעשות בנו ובילדינו ניסויים בלי לבקש רשות. הסיפור הזה הוא קריקטורה גרוטסקית. אבל הוא לא נולד בחלל ריק: כמה מגמות שהבשילו בחודשי המגפה מעבירות חלק גדול יותר מהפיקוח על ניסויים קליניים למי שעשויים, לדברי מבקרים, להיות קשובים יותר למפתחי התרופות. ננסה להפריד את העובדות מההפרזות.
בשבועות האחרונים נפוצו ברשתות שמועות מבהילות. "ממש לפני כמה חודשים פוזרה בישראל הוועדה הישראלית לניסויים בבני אדם!", נאמר בפוסט מ-27 באפריל שתקף את הפגיעה של הרשויות בחולי קורונה. "לפי נוהל חדש שייכנס לתוקף ב-1 במאי, 'החוקר, או כל אחד שבסמכותו לשפוט אם מטופל חיוני לניסוי, יוכל לקבל פטור מהסכמה מדעת ולצרף אדם לניסוי אף ללא הסכמתו!!!'" מאחורי השינוי, נאמר, עומדות יצרניות החיסונים. פוסט ויראלי אחר גרס: "כל הצוות הקודם שהיה אחראי על הנושא התפטר". ב-10 במאי שיתפו מאות אנשים קריאה לחרם הפגנתי: "לא שולחים ילדים למוסדות חינוך עד שלא ישנו את החוק של ניסויים בבני אדם בלי הסכמה! אנחנו לא חיות!"
משרד הבריאות הכריז על השמועה הזאת "פייק ניוז", וכפי שנראה, הכותבים חיברו כאן כמה נקודות באופן שגוי. אבל במפתיע, היו להם נקודות ממשיות לחבר.
אכן, משרד הבריאות התכוון לעדכן במאי את הנוהל לניסויים בבני אדם שלפיו פועלות ועדות הלסינקי - הגופים האחראים על כך שניסויים קליניים יעמדו בסטנדרטים של אתיקה רפואית ומשפט בינלאומי - אם כי בסוף דחה זאת ליולי. אכן, הנוהל הזה מפרט מתי אפשר לוותר על הסכמה מדעת של הנבדקים. אכן, ארגון רופאים לזכויות אדם התריע על "כשלים חריפים" בנוהל. אכן, רוב חברי ועדת הלסינקי העליונה, לרבות היו"ר פרופ' סתוית אלון-שלו, התפטרו בפברואר במחאה על צעדים שקידם מנכ"ל משרד הבריאות היוצא משה בר סימן טוב. אכן, המנכ"ל אמר בגלוי שהשינויים יאפשרו למשוך לישראל יותר חברות תרופות בינלאומיות.
אלא שלא שינוי הנוהל הביא להתפטרות של חברי הוועדה. כדי להתיר את הפלונטר נתחיל במפה כללית של הגזרה.
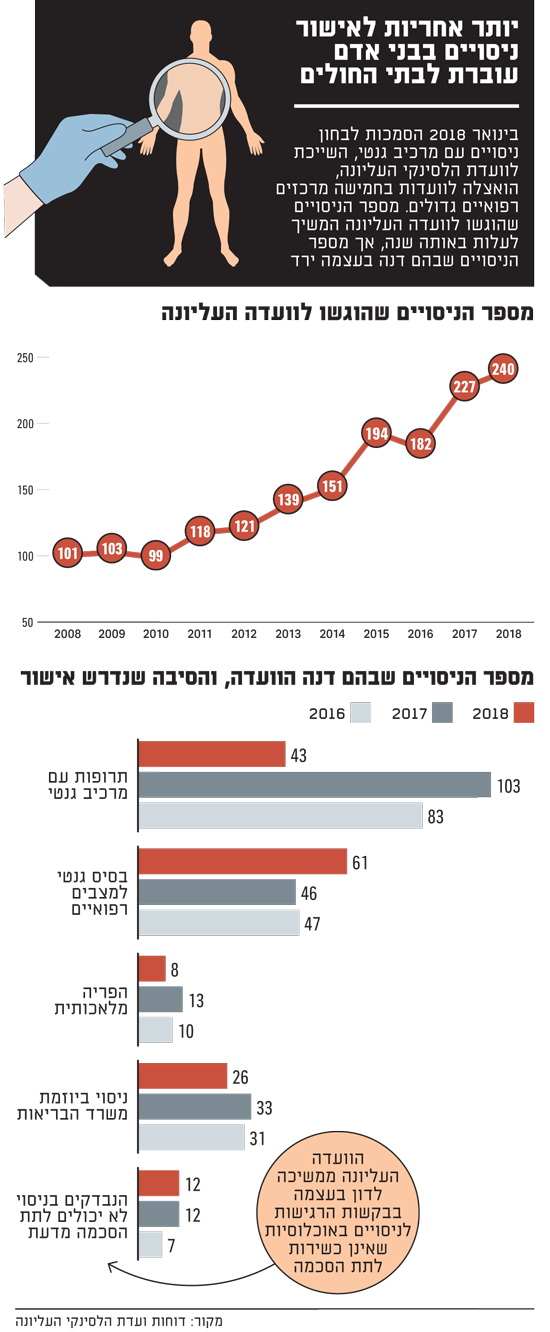
מי צריך לאשר? בתי החולים מרוויחים מהניסויים שנערכים בתחומם
פיתוח תרופות חדשות נעשה כיום, לטוב ולרע, בעיקר בחברות פרטיות. כשמגיעה העת לנסות אותן על נבדקים אנושיים, החברות פונות לבתי החולים. כל בתי החולים המרכזיים מפעילים יחידות לניסויים קליניים שמספקות שירות כזה. המוסדות מקבלים ניסיון מקצועי, תרופות חדשות ויקרות שעשויות להועיל למטופלים, וגם הכנסה כספית ניכרת. התשלום הישיר ששילמו המפתחים ב-2018 למוסדות בישראל הגיע ל-1.2 מיליארד שקל בערך.
על ההיבטים האתיים והמדעיים של הניסויים מפקחות ועדות הלסינקי - בלשון רבים. מלבד הוועדה העליונה במשרד הבריאות, שבימים אלה מנסים לאייש אותה מחדש, קיימת בכל בית חולים ועדה מוסדית. חלוקת העבודה ביניהן מעוגנת בתקנות בריאות העם, וכללי עבודתן מפורטים ב"נוהל 14" של אגף רוקחות שעליו חתום מנכ"ל משרד הבריאות.
כל הוועדות האלה כפופות לעקרונות הצהרת הלסינקי הבינלאומית, שאחד הכללים החשובים בה קובע שלא ייעשה באדם ניסוי אלא בהבנתו ובהסכמתו. אבל לעיקרון הזה יש חריגים, שנגיע אליהם, ונוהל 14 פורט אותם לפרטים.
אישור לניסוי ניתן על סמך הפרוטוקול שלו - מסמך מחייב שעשוי להקיף מאות עמודים, ומתאר מהי המתודולוגיה, אילו הכשרות יקבל הצוות הרפואי, איך ייבחרו הנבדקים, וגם איך תתבקש הסכמתם. חברי ועדת הלסינקי יכולים לדרוש תיקונים, לאשר בתנאים, וגם לפסול ניסוי לחלוטין.
כל ניסוי טעון אישור של הוועדה המוסדית. רק מיעוטם מחייבים אישור נוסף בוועדה העליונה. תקנות בריאות העם מונות שלושה מקרים כאלה: ניסויים בתרופות עם מרכיב גנטי (פארמקוגנטיים), בהפריה מלאכותית, וכאלה שיוזם משרד הבריאות (הוועדה העליונה פועלת כוועדה המוסדית שלו). מנכ"ל משרד הבריאות יכול להוסיף מקרים - ובין היתר הוא קבע שמקרים רגישים במיוחד של צירוף נבדקים בלא הסכמתם יועברו אליה.
חלוקת העבודה הזאת היא סלע המחלוקת, שכן יש הבדלים מבניים בין הוועדות. אומנם, ועדת הלסינקי של בית חולים אמורה להיות עצמאית, מורכבת מאנשי מקצוע שמכהנים בלי תמורה, וכמו הוועדה העליונה כוללת נציג ציבור. אבל היא חלק ממוסד שחברות התרופות מספקות לו הכנסה.
יותר אחריות עוברת לבתי החולים
ועדת הלסינקי העליונה: טענות על סרבול והשינוי של בר סימן טוב
מה שגרם לפיצוץ בוועדה העליונה היה שינוי שקידם בר סימן טוב בשנים האחרונות, כדי לפשט מה שחברות התרופות תופסות כביורוקרטיה מיותרת. בראשית 2018 "האצילה" ועדת הלסינקי העליונה את סמכותה החוקית לאשר ניסויים פארמקוגנטיים לחמש ועדות הלסינקי נבחרות במרכזים רפואיים. כשמוגש לה פרוטוקול ניסוי, היא יכולה לתת לוועדה מוסדית כזאת להחליט "בשמה". בדיון שנערך אז בכנסת בהצעת חוק לניסויים בבני אדם (שלא הבשילה בינתיים), גם נציגת קופת חולים מכבי טענה שאין צורך שכל ניסוי גנטי יחכה לאישור של הוועדה העליונה. ואמנם, בין 2017 ל-2018 צנח מספר הניסויים הפארמקוגנטיים שהוועדה העליונה דנה בהם בפועל מ-103 ל-43.
ההתפטרות של חברי הוועדה באה אחרי שבינואר השנה הודיע בר סימן טוב על הוספת שמונה מוסדות להסדר הזה, ואחרי חצי שנה עוד שישה. מתברר שלא כל חברי הוועדה הרגישו שהם "הסכימו מדעת" לרפורמה. "צריך להמציא פועל חדש שיבטא את העובדה שנכפה עליך להאציל סמכויות כשאתה משוכנע שזה אסון", אמר לנו הרב יובל שרלו, שהיה חבר הוועדה במשך שנים. "זו מכבסת מילים, שכן הוועדה לא האצילה שום דבר: מנכ"ל משרד הבריאות פשוט החליט להעדיף את חברות הפארמה על האתיקה". לדבריו, ההאצלה תוריד את אמות המידה לאישור ניסויים, שכן "הוועדות המקומיות חלשות מעצם טיבן המקומי, הלויאליות לקולגות וכדומה".

משה בר סימן טוב / צילום: שלומי יוסף, גלובס
לדבריו בר סימן טוב טען תחילה שהוועדה העליונה אטית ומסורבלת. "לאחר שהוצגו בפניו נתונים חד משמעיים ליעילות, למהירות ולמקצועיות של הוועדה העליונה, הטיעון התחלף ב'נגמר עידן הבולשביקיות', שיש לתת אמון בוועדות המקומיות ולהותיר את הוועדה העליונה לנושאים צדדים ולא חשובים". במשרד הבריאות דוחים את הגרסה הזאת.
האם הוועדה העליונה באמת מסורבלת? מה שאנחנו יודעים הוא שהוועדה מתכנסת בערך פעם בחודש, ושהנוהל מחייב אותה לרוב להחליט תוך חודשיים - לא רחוק מהזמנים שמבקריה טוענים שנהוגים בחו"ל. גורמים בענף שלרוב היא לא חורגת בזמנים. יתר על כן: יוזמי הניסוי רשאים להגיש את הפרוטוקול במקביל לוועדה המוסדית ולוועדה העליונה.
פישוט אחר שמקדם משרד הבריאות בהליכי האישור, שנמצא היום בשלב הפיילוט, הוא הקמת ועדה ארצית שתדון בפרוטוקולים של ניסויים שנעשים במקביל בכמה בתי חולים. במקום שכל ועדת הלסינקי מוסדית תעיר הערות בנפרד, הוועדה הארצית בוחנת את המסמכים, וכל מוסד מחליט בסוף אם להצטרף לניסוי. אבל הצעד הזה לא אמור לגרוע מתפקיד הוועדה העליונה, שתמשיך לדון גם בניסויים כאלה במקרה שהם טעונים את אישורה.
מפתחי התרופות: תהליך ארוך, יקר ומפוקח
בר סימן טוב, בחוזר שהפיץ, כתב במפורש שייעול תהליך האישור של ניסויים פארמקוגנטיים נועד להתחרות על לב חברות התרופות, או בלשונו, להגיב על "התחרות הבינלאומית מצד מדינות על ביצוע הניסויים בתחומן". אבל אין חובה להניח שהוא נועד לעקוף עקרונות אתיים, בפרט במה שנוגע להסכמת הנבדקים.
נסתכל בתהליך מנקודת המבט של מפתחי התרופות. עובדים ישראלים בענף תיארו באוזנינו את המסלול ארוך השנים, מרגע שנולד רעיון לתכשיר חדש, שלכל אורכו פוקחים עליהם עין גורמים חיצוניים. זה כרוך בניסויים מדוקדקים במעבדה, בדיקות רעילות, ניסוי בבעלי חיים. נציגי רגולטורים מחו"ל, ובראשם מינהל המזון והתרופות של ארה"ב (FDA), יכולים לקפוץ לביקור, לבדוק את מערכי הניסוי והשיטות הסטטיסטיות, ולחייבם בהינף קולמוס למקצה שיפורים ארוך. והחברה משלמת על שהותם.
כדי להמשיך לניסויים בבני אדם, החברה צריכה לאתר מוסד רפואי (רצוי גדול, עם גישה לנבדקים רבים), למצוא חוקר ראשי מטעמו, להתמקח על חוזה מפורט ולכתוב יחד את הפרוטוקול. ההכנות כוללות שלל אתגרים שאדם מבחוץ לא מודע להם. למשל, השקעה בפיתוח פלצבו (תרופת דמה) שייראה בדיוק כמו התכשיר האמיתי. רק אז אפשר לבקש אור ירוק מוועדות הלסינקי.
השלמת התרופה מחייבת לחזור על התהליך בשלושה ניסויים עוקבים (פאזות) עם מספר הולך ועולה של נבדקים. השלב האחרון עשוי להתפרש על כמה מדינות ולעלות יותר מ-100 מיליון דולר. חברה קטנה לא תעמוד בו בלי לחבור לאחת הענקיות העולמיות. הכנת המסמכים לוועדות, תיקונם לפי ההערות, ניהול מאגר מידע על מצב הנבדקים, דיווחים שוטפים למשרד הבריאות, לבית החולים ולמטה החברה המפתחת - כל אלה מחייבים היררכיה שלמה של עובדות ועובדים, לרוב בעלי רקע בביולוגיה או ברפואה. בישראל, כמו במדינות אחרות, צמחו חברות שירות מיוחדות שמסייעות למפתחי התרופות בניהול הניסויים הקליניים, מהזווית המשפטית והרפואית.
רמי גלעד, ד"ר לביולוגיה שמשמש מנהל אבטחת איכות באחת החברות האלה, GCP, אומר שהשינויים שמשרד הבריאות מקדם נועדו למנוע כפילות מיותרת. הוא לא יצטרך לקבל הערות נפרדות על אותו ניסוי מוועדות הלסינקי של כמה מוסדות, ולהתעסק בו זמנית עם ועדות מוסדיות ועם הוועדה העליונה במשרד הבריאות. ממילא, גם יו"ר ועדה מוסדית מוסמך לעצור ניסוי שהתגלו בו פגמים.
לדברי גלעד, גם השינויים שמתכנן משרד הבריאות בנוהל 14, שהשמועות הוויראליות הציגו כפתח לעשיית ניסויים באנשים ללא הסכמתם, נועדו בעיקר לפשט את הגשת הטפסים. שום הקלות לא נעשו בו בתחום ההסכמה מדעת.
פטור מהסכמה מדעת: אין שינוי מהותי בנוהל
וכאן אנחנו מגיעים סוף סוף לשאלה: האם הנוהל החדש מצמצם את החובה לקבל הסכמה מדעת, ואיך זה קשור למשבר הקורונה?
גם הנוסח המעודכן של הנוהל וגם הנוסח הקיים, משנת 2016, זמינים לעיון באתר משרד הבריאות. דובר משרד הבריאות אמר לנו, כמו גלעד, שכל השינויים בתחום ההסכמה מדעת "נוגעים לאיחוד טפסים, ואינם מהווים שינוי מהותי". וככל שאנחנו מסוגלים לשפוט - שניהם צודקים. נשווה יחד בין הנוסחים.
כפי שאמרנו, דרך המלך בגיוס נבדקים לפי עקרונות הלסינקי היא התנדבות מרצון, אחרי הסברים מפורטים ובהסכמה בכתב. ועדות הלסינקי לא מאשרות כל משתתף בנפרד: כמו בשאר היבטי הניסוי, הן בוחנות מראש את השיטות שמארגני הניסוי פירטו בפרוטוקול, לרבות דברי ההסבר והטפסים שיוגשו לנבדקים.
גם בנוהל הקודם, שנוסח הרבה לפני הופעת הקורונה, מפורטים שני מקרים שבהם ועדת הלסינקי מוסדית מוסמכת לאשר בעצמה פטור מהסכמה כזו. הראשון נוגע ל"מצב חירום רפואי". בניגוד למה שקוראים מסוימים הבינו בטעות, הכוונה אינה למצב חירום ארצי כגון מגפה, אלא לחירום אישי: סכנת חיים או נכות שהמטופל נמצא בה. אם יש בסיס להניח שהטיפול הניסיוני יסייע לו, ואם אין פתרון אחר, ואם אי אפשר ליצור בזמן קשר עם נציגיו - אפשר לפטור את החוקרים מלקבל את הסכמתו. וגם אז נחוץ אישור של רופא נוסף שאינו חבר צוות המחקר.
במצבים דחופים שאין בהם סכנת חיים, הוועדה המוסדית יכולה לאשר פטור מהסכמה בכתב. הרופא יסביר למועמד בעל פה את פרטי הניסוי, בנוכחות עד, וגם ההסכמה יכולה להיות בעל פה.
אוכלוסיות רגישות: הוועדה העליונה ממשיכה לדון
במקרה אחרון, ורגיש במיוחד, הנוהל הקיים מחייב אישור גם מהוועדה העליונה: צירוף נבדקים שהטיפול לא יועיל להם אישית, אבל גם לא מסוגלים לתת הסכמה מדעת. התנאי הוא שאין אפשרות לבצע את הניסוי באוכלוסיות רגילות. דוגמה לכך היא תרופה חדשה לאלצהיימר: אפשר לנסות אותה רק על קשישות וקשישים שלקו במחלה, שאינם כשירים להסכים. הנוהל של משרד הבריאות לא מחייב במקרים כאלה הסכמה בכתב אפילו מקרובי משפחה של הנבדק. אם הם "נמצאים במקום" יש ליידע אותם, ואם הם מתנגדים - יש לכבד את התנגדותם. אבל הנוהל מדגיש שאין חובה לקבל הסכמה מהם.
החשש מניצול לרעה של האפשרות הזאת מסביר מדוע נדרש כאן אישור של הוועדה העליונה. ב-2005 פרסם מבקר המדינה דוח חמור על ניסויים שנעשו בקשישים בבית החולים הגריאטרי הרצפלד בגדרה, שהוביל לחקירה פלילית נגד 21 רופאים. הדוח נותר חסוי, אבל ידוע שנמתחה בו ביקורת על יו"ר ועדת הלסינקי המוסדית של הרצפלד, פרופ' אברהם אלירז. בעקבות השערורייה פרסם משרד הבריאות ב-2006 נוהל מעודכן שהקשיח את הנהלים הכרוכים בניסויים באוכלוסיות רגישות, הדגיש שהם צריכים להיעשות במשורה, ולעבור תמיד אישור של הוועדה העליונה.
כל העקרונות לפטור מהסכמה מדעת שנמצאים בנוסח הקודם של הנוהל מצויים גם בנוסח החדש, לפעמים בלשון בהירה ומפורטת יותר. במקרה של קטינים, לדוגמה, שני ההורים או האפוטרופסים חייבים לחתום על הסכמה. רק בנסיבות מיוחדות אפשר להסתפק באחד, ובתנאי שוועדת הלסינקי של המוסד אישרה זאת מראש. כך או כך, חובה לתת הסבר פשוט לקטין ולהתחשב בדעתו. אצל "חוסים ופסולי דין" נדרשת הסכמה של האפוטרופוס; אם בני משפחה שאינם אפוטרופסים מביעים התנגדות, הנוהל ממליץ לא לצרף את הנבדק לניסוי. גם במקרים החריגים שבהם אפשר לפטור את החוקרים מקבלת הסכמה, התנאים הישנים נותרו על כנם. לא נראה שצומצם מגוון המקרים שמחייבים אישור בוועדה העליונה.
האם האצלת סמכויות הוועדה העליונה לוועדות מוסדיות תאפשר לעקוף את העיקרון הזה? בדוח הוועדה מ-2018 נאמר שההאצלה לא תחול על ניסויים באנשים בלי כושר הסכמה מדעת. לפי הנתונים, מספר הבקשות האלה שנידונו בוועדה העליונה נותר כשהיה.
ביקורות חשובות, לא חדשות: רופאים לזכויות אדם: "כשלים חמורים"
ובכל זאת, לא רק מתנגדי חיסונים נבהלו מהנוהל החדש. חברי ועדת האתיקה של עמותת רופאים לזכויות אדם (רל"א) שיגרו לבר סימן טוב מכתב בקריאה להקפיא את הנוהל בשל "כשלים חמורים". במה מדובר?
אף שההודעה על המכתב באתר רל"א נפתחת במילים "בחסות הקורונה", המכתב עצמו לא קשר בין פרסום הנוהל ובין המגפה. הוא הציג בעיקר בעיות שאנשי רל"א מזהירים מהן כבר שנים. למשל, שהכללים לניסויים בבני אדם מעוגנים בתקנות בלבד ולא בחקיקה, דבר שמקל על שינויים, ומביא לכך שגופים כמו צה"ל אינם כפופים להם רשמית. למשל שכללי ההסכמה מדעת לא מגנים מספיק על אוכלוסיות רגישות. אלה ביקורות חשובות, אבל לא חדשות.
כמו כן, ברל"א טוענים שהנוהל מקל על חברות התרופות לנצל מידע גנטי (אנונימי) שנאסף בניסוי. הדס זיו, מנהלת פעילות ואתיקה ברופאים לזכויות אדם, הסבירה לנו שבארגון מוטרדים באופן כללי מהנכונות של הממשלה להעביר לגופי מחקר פרטיים מידע גנטי יקר ערך על מטופלים, בלי אישורם ובלי תמורה הולמת. המגמה הזאת מתגלה לא רק בשדה הניסויים הקליניים, אבל היא נושא לכתבה אחרת.
אם כן, העובדות, ככל שיכולנו לברר אותן, לא תומכות בטענה שהשינויים בנוהל לניסויים בבני אדם נועדו לצמצם זכויות של חולי קורונה. באתר הניסויים הקליניים של משרד הבריאות מפורטים עשרות ניסויים כאלה שמבוצעים בימים אלה. לפי המידע שקיבלנו, לא ניתן בהם פטור מהסכמה מדעת. לעתים ההסכמה תועדה בשיחת וידאו כדי להימנע ממגע עם החולה. ניסויים עם מרכיב גנטי ממתינים לאיוש הוועדה העליונה.
לקריאה נוספת:
תקנות בריאות העם (ניסויים רפואיים בבני אדם), התשמ"א - 1980
אגף רוקחות במשרד הבריאות - הנוהל לניסויים רפואיים בבני אדם
ההסתדרות הרפואית העולמית - הצהרת הלסינקי
הוועדה העליונה לניסויים בבני אדם - דוח לשנת 2018
ועדת המדע - "מעקב אחר התקדמות הליך החקיקה בהצעת חוק ניסויים רפואיים בבני-אדם", 1.5.2018
רופאים לזכויות אדם - "נוהל הסכמה מדעת בניסויים בבני-אדם - כשלים חמורים והעדר חקיקה", 30.4.2020